Weitere Forschungsschwerpunkte
Lehrstuhl für Biochemie und Molekulare Medizin
Leitung:
Prof. Dr. Anja Katrin Boßerhoff
Institut für Biochemie
Lehrstuhl für Biochemie und Molekulare Medizin (Prof. Dr. Bosserhoff)
- Telefon: +49 9131 85-24190
- E-Mail: anja.bosserhoff@fau.de
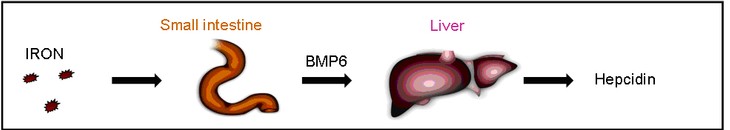
BMPs (Bone Morphogenetic Proteins) sind schon lange als Modulatoren des Eisenstoffwechsels in der Leber bekannt. Durch einen erhöhten Eisenspiegel wird die BMP Expression induziert. Wir konnten zeigen, dass hierbei BMP6 der Hauptregulator ist und ausgehend vom Dünndarm die Regulation von Hepcidin in der Leber steuert (Arndt et al., 2010, Gastroenterology).
Weiterhin spielen BMPs bei diversen Krebserkrankungen eine große Rolle.
In unseren Untersuchungen konnten wir zeigen, dass insbesondere die Aktivierung des BMP spezifischen Smad Signalwegs auch an der Progression des Hepatozellulären Karzinoms (HCC) beteiligt ist (Maegdefrau et al., 2012, Exp Mol Pathol).
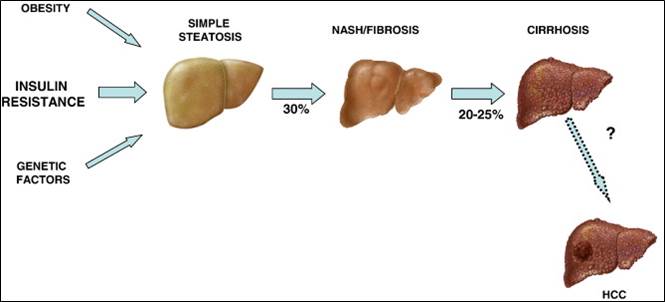
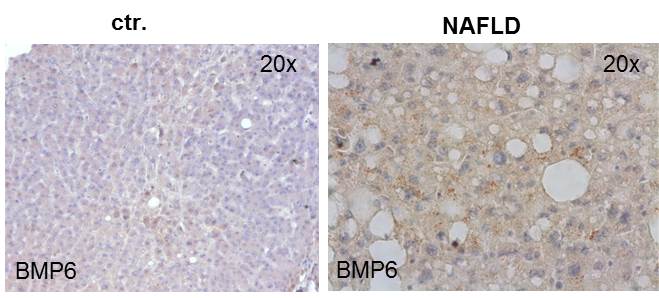
In laufenden Studien wird untersucht, welche Funktionen BMPs in NAFLD (non-alcoholic fatty liver disease) besitzen, da Untersuchungen an NASH (non-alcoholic steatohepatitis) Mausmodellen und NAFLD Patienten eine starke BMP6 Induktion in der geschädigten Leber zeigten.
Es ist bereits bekannt, dass die Familie der BMPs (Bone Morphogenetic Proteins) während der Wundheilung aber auch in fibrotischen Erkrankungen der Haut wie der Sklerodermie oder dem Keloid eine Rolle spielen. Die genaue Funktion einzelner BMPs in diesen physiologischen bzw. patho-physiologischen Prozessen ist jedoch weitgehend unbekannt.
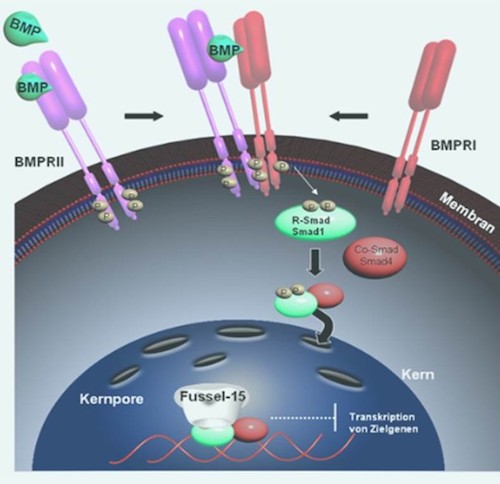
In unseren Untersuchungen versuchen wir, die molekulare Funktion des Smad Inhibitors Fussel-15 (funcional smad suppressing element on chromosome 15) und BMP6 im Rahmen der Wundheilung aufzuklären. Ferner wird die Bedeutung und die Regulation dieser Moleküle in pathophysiologischen Prozessen analysiert.
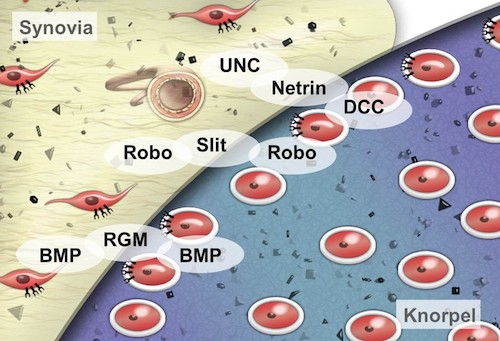
Die Familie der Repellentfaktoren wurde erstmalig bei der Nervenentwicklung (Axonwachstum) beschrieben. Wir untersuchen die Regulation und Funktion dieser Faktoren in unterschiedlichen Zelltypen des synovialen Gelenks, wie z.B. in Chondrozyten und in Synovial-fibroblasten sowie in humanen mesenchymalen Stammzellen (hMSC) in entzündlichen bzw. degene-rativen Erkrankungen wie rheuma-toider Arthritis (RA) und Osteoarthrose (OA). Dabei liegt der Fokus auf den Repellentfaktoren der Netrine und Slits und deren Rezeptoren UNC/ DCC und Roundabout (Robo). Bei der Analyse regulatorischer Mechanismen zeigte sich, dass bestimmte miRNAs in den Erkrankungen fehlreguliert sind und so auch die Expression verschiedener Gene in den Erkrankungen reguliert wird. Dadurch lassen sich möglicherweise neue Targets für die Therapie von RA und OA identifizieren.
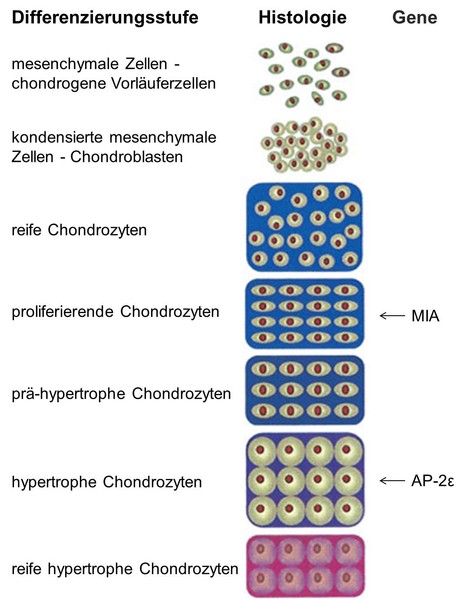
Das Molekül MIA, auch CD-RAP (Cartilage-drived retinoic acid-sensitiv protein) genannt, wird nicht nur von Melanomzellen exprimiert, sondern auch von Chondrozyten. Analysen der MIA/CD-RAP-knockout-Maus haben gezeigt, dass MIA/CD-RAP eine Rolle bei der Interaktion von Chondrozyten mit der Matrix spielt, die Proliferation von mesenchymalen Zellen hemmt und deren Differenzierung zu Chondrozyten fördert. Desweiteren konnte eine erhöhte Regenerationsfähigkeit des Knorpels in MIA/CD-RAP-knockout-Mäusen während der Osteoarthrose und der Frakturheilung aufgedeckt werden.
Es soll der molekulare Mechanismus charakterisiert werden, mit dem MIA/CD-RAP die Knorpeldifferenzierung beeinflusst und dessen Bedeutung in pathologischen Prozessen weiter erforscht werden.
Auch der Transkriptionsfaktor AP-2ε ist an der Knorpeldifferenzierung beteiligt. Wir konnten zeigen, dass AP-2ε die Knorpeldifferenzierung in der hypertrophen Differenzierung von Chondrozyten fördert. Untersucht wird hier nun die genaue Funktion des Transkriptionsfaktors in der Knorpelentwicklung und die Regulation von Zielgenen.
Zusätzlich spielt AP-2ε eine Rolle bei der Knorpelerkrankung Osteoarthrose und wird dort verstärkt exprimiert. Auch die Funktion im Rahmen der Erkrankung soll analysiert und aufgeklärt werden.
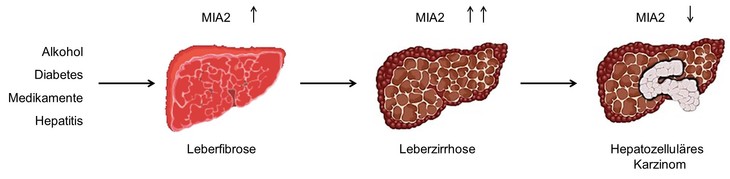
Das Protein Melanoma Inhibitory Activity 2 wurde mittels Gensuche als MIA Homolog entdeckt und wird im Gegensatz zu MIA spezifisch in Hepatozyten exprimiert. Untersuchungen haben gezeigt, dass das Protein bei einer Leberschädigung, zum Beispiel einer Leberfibrose oder -zirrhose, verstärkt gebildet wird, wohingegen dessen Expression im Hepatozellulären Karzinom (HCC) herunterreguliert ist. Aufgrund dieser Eigenschaften wurde MIA2 als Tumorsuppressor und potentieller Leberschädigungsmarker beschrieben. Wir untersuchen MIA2 in vitro im Hinblick auf mögliche Interaktionspartner, Lokalisation und dessen molekulare Funktion. Außerdem soll die Funktion des Proteins in vivo mit Hilfe eines MIA2 knockdown Mausmodells analysiert werden.
Plasma Medizin ist die zusammenfassende Bezeichnung für die Anwendung von physikalischen Plasmen für therapeutische Zwecke. Es handelt sich dabei um ein recht neues Wissenschaftsgebiet an der Schnittstelle zwischen Physik, Medizin und Biologie. Mögliche Einsatzgebiete von Plasmen im Bereich der Medizin umfassen beispielsweise die Desinfektion oder Sterilisation von Medizinprodukten, von Körperoberflächen, die Behandlung von Wunden, Haut- oder entzündlichen Erkrankungen.
Unser Ziel ist es, die zelluläre Funktion und die molekularen Mechanismen von Plasma im Rahmen der Wundheilung, aber auch bei der Behandlung von Tumorerkrankungen zu erforschen.

In enger Kooperation mit der Arbeitsgruppe von Prof. Dr.-Ing. Peter Haring Bolivar (Universität Siegen, Lehrstuhl Höchstfrequenztechnik und Quantenelektronik) wird ein Verfahren entwickelt, um die Hybridisierung von DNA-Strängen ohne Markierung der DNA nachzuweisen. Dieses Verfahren soll in der Entwicklung der sogenannten DNA-CHIP-Technologie Eingang finden. Aus dieser Kooperation ist bereits ein Patent auf das neu entwickelte Verfahren hervorgegangen.
In der Arbeitsgruppe beschäftigen wir uns mit der Entwicklung 3D-gedruckter Zellmodelle, die einerseits unterschiedliche Aspekte der Tumorentstehung und –progression darstellen (im Rahmen des DFG-geförderten Sonderforschungsbereiches Transregio 225 (SFB TRR225, Biofabrikation; Projekt C03, Z03)) bzw. auf die Bedeutung der Biomechanik im Rahmen der Hirnentwicklung bzw. Tumormetastasierung ins Gehirn abheben (SFB 1540, EBM, Projekt C04). Diese Modelle zeigen durch die Einbeziehung von extrazellulärer Matrix, weiterer Zelltypen und Dreidimensionalität eine verbesserte Übertragbarkeit auf das in vivo System verglichen mit herkömmlichen Zellkulturmodellen. Wir stellen grundwissenschaftliche Fragen zur Entstehung ruhender Tumorzellen, der Tumor Dormancy, und zur zellulären Differenzierung, die durch diese innovativen, kontrollierbaren Modelle beantwortet werden können.


