AG Dietrich
AG Dietrich
Leitung:
PD Dr. med. Dr. rer. physiol. habil. Peter Dietrich
Institut für Biochemie
Lehrstuhl für Biochemie und Molekulare Medizin (Prof. Dr. Bosserhoff)
- Telefon: +49 9131 85-29384
- E-Mail: peter.dietrich@fau.de
Forschungsinteressen
Maligne Tumorerkrankungen wie das maligne Melanom (MM) und das hepatozelluläre Karzinom (HCC) zeigen schnell zunehmende Inzidenzraten weltweit und sind für einen wesentlichen Teil tumor-assoziierter Morbidität und Mortalität verantwortlich.
In fortgeschrittenen Stadien erhalten Patienten mit MM und HCC standardmäßig (B)RAF-Inhibitoren wie Vemurafenib oder Sorafenib, welche in den für Tumorzellen entscheidenden MAPK-Signalweg eingreifen. Leider kommt es jedoch bei der Mehrzahl der Patienten unter diesen Therapien innerhalb weniger Monate zu einer Therapieresistenz, was zu einem meist schnell progressiven und schließlich tödlichem Ausgang der Tumorerkrankungen führt. Daher ist ein besseres Verständnis der molekularen Mechanismen der Entstehung und Progression dieser Tumorerkrankungen sowie insbesondere die Aufklärung der molekularen Mechanismen der Entstehung von Therapieresistenzen von entscheidender Bedeutung, um die Prognose und Lebensqualität von Patienten zu verbessern.
Die Ziele unserer Forschung sind daher i) das Aufzeigen von neuen, für die Krebsprogression relevanten Genen des hepatozellulären Karzinoms sowie des malignen Melanoms (mit Fokus auf die Lebermetastasierung des Melanoms), ii) ein besseres Verständnis der Entstehung von Therapieresistenzen gegen (B)RAF-Inhibitoren im MM und im HCC, sowie iii) eine klinische Translation unserer Erkenntnisse, um neue, potentielle therapeutische Möglichkeiten zu evaluieren.
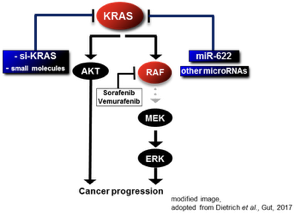
Wir konnten bisher mittels microRNA-Zielgen-Expressionsprofilen in Krebszellen mehrere neue Zielgene für das HCC und das MM identifizieren, welche in abgeschlossenen und laufenden Studien untersucht wurden/werden. Hierbei werden molekularbiologische, biochemische, sowie verschiedene Datenbankanalysen und Patientengewebeanalysen verwendet. Es wurde mit der microRNA-622 eine potente tumorsuppressive microRNA im HCC sowie im Melanom gefunden und mit wild-typ KRAS ein neues, therapeutisch relevantes Onkogen in diesen Tumorarten identifiziert. Wild-typ KRAS zeigte sich in vitro und in vivo stark exprimiert und korrelierte in Patientengeweben mit Tumorgröße und Überleben. Sowohl die Anwendung einer synthetischen microRNA-622 als auch eine si-RNA- oder small molecule-vermittelte Inhibition von wild-typ KRAS führte in beiden Tumorarten in vitro und in verschiedenen Mausmodellen zu starken tumorsuppressiven Effekten. Sowohl bei BRAF-Inhibitor-Resistenz im malignen Melanom als auch bei Sorafenib-Resistenz im HCC zeigte sich die wild-typ Variante von KRAS als vermehrt exprimiert in resistenten Zelllinien. Eine KRAS-Inhibition konnte in beiden Tumorarten zu einer Durchbrechung der Therapieresistenz führen. In laufenden und zukünftigen Studien werden potentielle therapeutische Herangehensweisen einer wild-typ KRAS Hemmung in den genannten Tumorarten evaluiert sowie weitere konventionelle und nicht-konventionelle wild-typ RAS-Proteine hinsichtlich ihrer potentiellen therapeutischen Funktion im MM und im HCC weiter untersucht. Zudem werden weitere neue microRNAs sowie deren Zielgene und zusätzliche Zielgene der potenten microRNA-622 in beiden Tumorarten näher charakterisiert.