AG Bosserhoff (Lehrstuhl 1)
Lehrstuhl für Biochemie und Molekulare Medizin
Leitung:
Prof. Dr. Anja Katrin Boßerhoff
Institut für Biochemie
Lehrstuhl für Biochemie und Molekulare Medizin (Prof. Dr. Bosserhoff)
- Telefon: +49 9131 85-24190
- E-Mail: anja.bosserhoff@fau.de
Forschungsschwerpunkt: Melanom
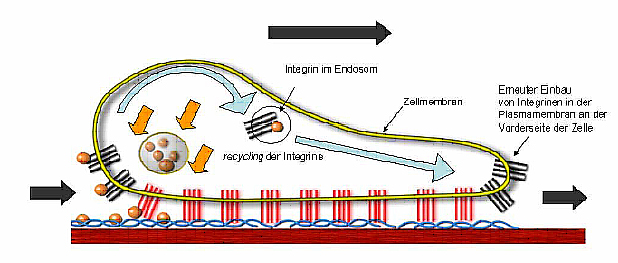
Seit der Aufklärung der 3D-Struktur des Proteins fokussieren sich unsere Untersuchungen auf die Identifikation von MIA-bindenden Proteinen sowie auf Peptide und Small Molecules, die das MIA-Protein funktionell inhibieren können.
Um die Rolle des MIA-Proteins in der Entstehung und Progression des malignen Melanoms besser zu verstehen, arbeiten wir mit einem Melanom-Mausmodell, welches innerhalb von 3-4 Monaten spontan Haut-Tumore entwickelt. Die Kreuzung dieser Melanom-Mauslinie mit der MIA-defizienten Maus soll Aufschluss darüber geben, ob MIA in der frühen Entstehungsphase maligner Melanome beteiligt ist und welche molekulare Rolle es dabei einnimmt.
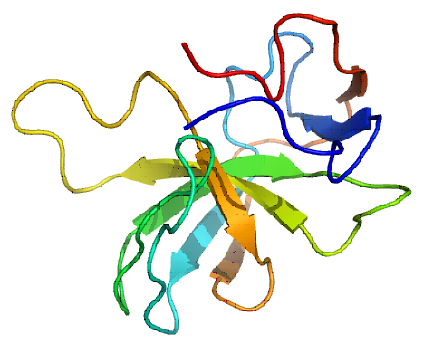
Ferner gibt es Hinweise, dass MIA regulierend auf weitere Proteine wirkt. Aus diesem Grund untersuchen wir die Regulation von p54nrb durch MIA und die Rolle, die dieses Protein in der Entstehung, Progression und Metastasierung von Melanomen spielt.
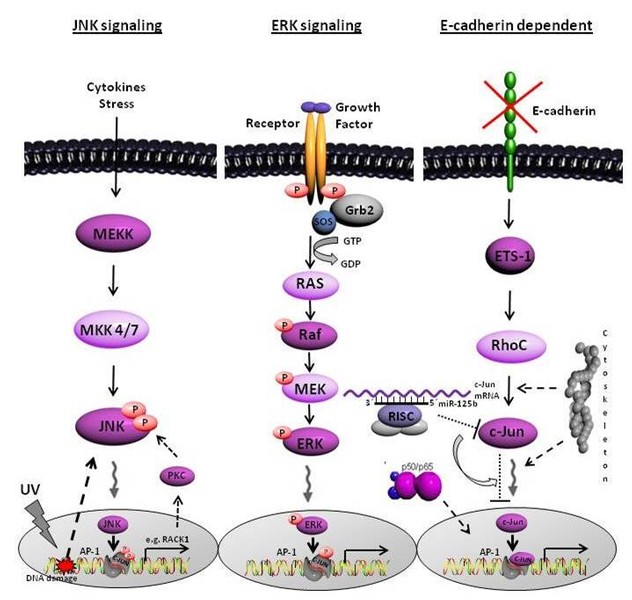
Desweiteren ist das Protoonkogen c-Jun, welches zur Familie der AP-1 Transkriptionsfaktoren gehört, im Melanom stark überexprimiert. Wir konnten zeigen, dass ein Link zwischen dem Verlust von E-cadherin und der Expression von c-Jun besteht. Neben den bereits bekannten Regualtionsmechanismen von AP-1 über JNK/ ERK stellt die Signalkaskade, ausgelöst durch den Verlust von E-cadherin, einen wichtigen Regualtor der AP-1 als auch NfkappaB Aktivität im Melanom dar. Des weiteren konnte die Regulation des Transkriptionsfaktors c-Jun durch die miR-125b auf translationaler Ebene identifiziert werden. Die Beteiligung weitere Moleküle und des Zytoskeletts an der Regulation und Aktivierung von c-Jun/ AP-1 im Melanom werden aktuell in unserer Arbeitsgruppe untersucht.
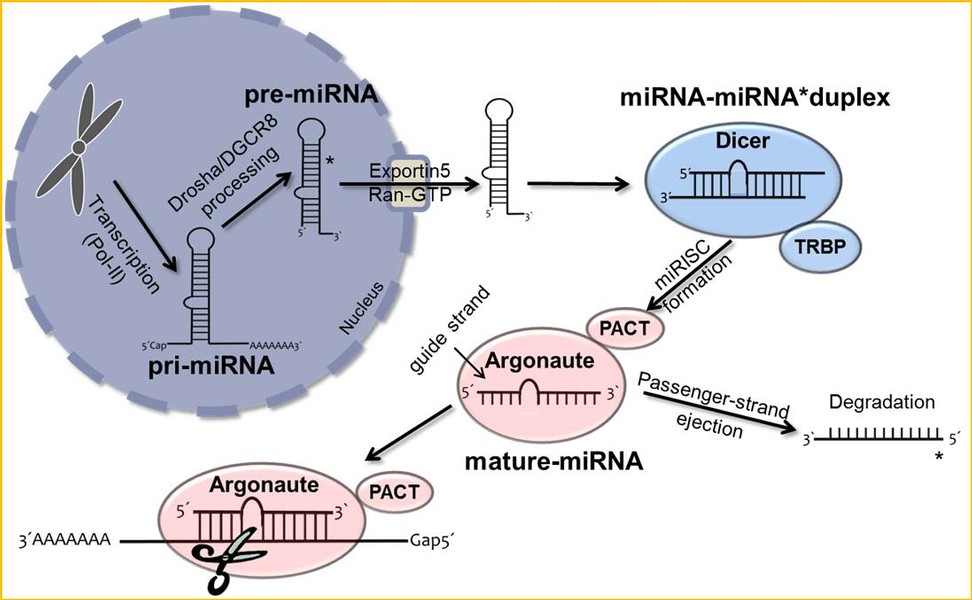
MicroRNAs (miRNAs) sind kurze, nicht-proteincodierende RNA-Moleküle, die spezifisch an die Transkripte ihrer Zielgene binden und deren Expression durch Regulation der mRNA-Stabilität und deren Expressin durch Regulation der mRNA-Stabilität und der Translation kontrollieren.
Aufgrund der pleiotropen Auswirkungen dieser Negativregulatoren auf die globale Genexpression wird miRNAs auch eine wesentliche Rolle bei Entstehung und Progression aller Arten von Tumoren zugeschrieben. Dennoch ist ihre Bedeutung im Rahmen der Tumorigenese des malignen Melanoms noch weitgehend ungeklärt.
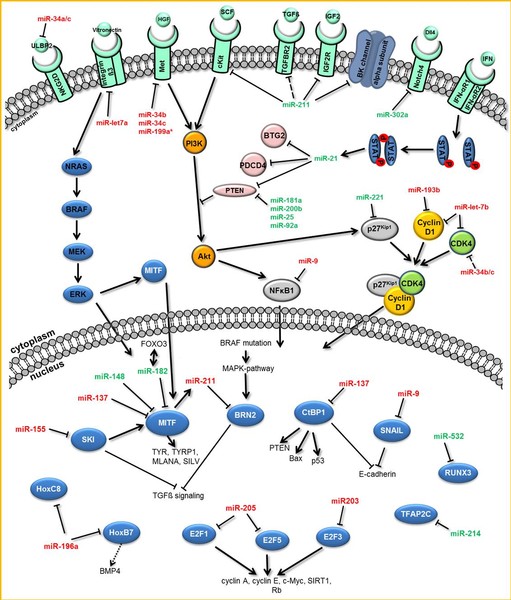
Neben der Funktion der maturen miRNAs als entscheidende posttranskriptionale Regulationselemente, steht auch ihre Prozessierung und deren Charakterisierung im Melanom im Zentrum unserer aktuellen Forschung.
Clin Biochem)
Bone Morphogenetic Proteins (BMPs) sind Wachstumsfaktoren der TGFß- Proteinfamilie. Es ist bekannt, dass sie verschiedene zelluläre Prozesse wie Entwicklung, Differenzierung, Motilität und Proliferation in unterschiedlichen Zelltypen regulieren. Des Weiteren spielen sie eine wichtige Rolle bei der Entstehung und Progression verschiedener Tumorarten. Wir konnten zeigen, dass im Vergleich zu normalen Melanozyten BMP4 und BMP7 im malignen Melanom verstärkt exprimiert werden. Durch Induktion der Expression der Matrix-Metallo-Proteinasen (MMPs) fördern BMPs die Invasion und Migration der Melanomzellen. Zusätzlich stimulieren BMPs die Fibroblasten und Endothelzellen der Tumorumgebung zur Expression der MMPs und tragen somit zur Metastasierung bei. Neben den MMPs ist über weitere Zielgene der BMPs im Melanom ist bis dato wenig bekannt. Unsere weiterführenden Studien konnten zeigen, dass durch die verstärkte BMP-Expression im Melanom das Protein Dido-1 induziert wird. Die erhöhte Dido-1-Expression wiederum führt zur verstärkten Migration und Invasion der Tumorzellen, wodurch die Progression des Melanoms gefördert wird.
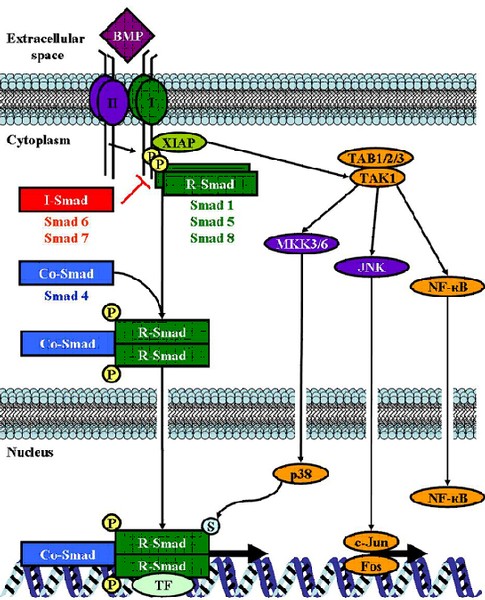
Des Weiteren wurde die regulatorische Ursache der verstärkten BMP-Expression im Melanom näher untersucht. Hier konnten wir zeigen, dass der Wachstumsfaktor bFGF sowie die Transkriptionsfaktoren HOX-B7 und Ets-1 für den erhöhten BMP4-Level im Melanom verantwortlich sind. Mit der MicroRNA „miR196-a“ konnte zudem ein weiterer regulatorischer Faktor des BMP-Signalweges im Melanom identifiziert werden.
Es gibt deutliche Hinweise darauf, dass neben BMP4 und BMP7 noch weitere Mitglieder der BMP-Familie eine wichtige Rolle in der Entstehung und Progression des Melanoms spielen könnten. Dies wird Gegenstand von weiterführenden Untersuchungen sein.
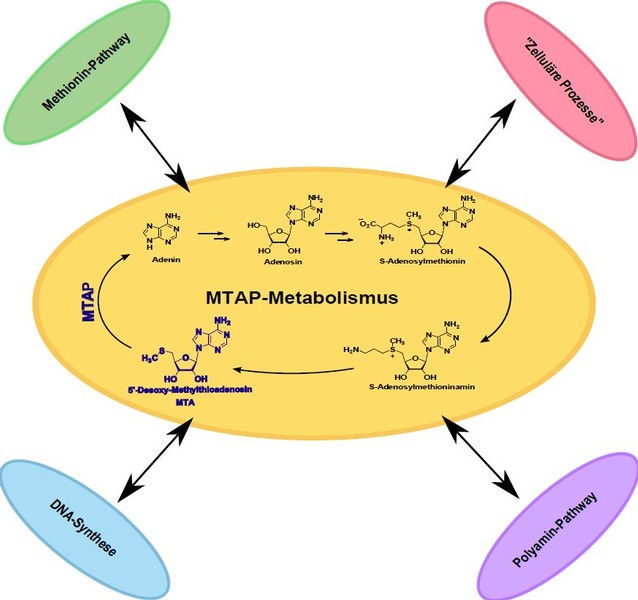
Das Enzym Methylthioadenosinphosphorylase (MTAP) ist ubiquitär im gesunden Gewebe vorhanden. Die Funktion dieses Enzyms ist die katalytische Spaltung von 5’-Desoxy-5’-Methylthioadenosin (MTA) in Adenin und 5΄-Methylthioribose-1-Phosphat. Weiter spielt diese Phosphorylase auch eine wichtige Rolle im Polyamin-Metabolismus. In vielen Tumorarten ist MTAP in seiner Expression stark herunterreguliert. Wir konnten in unserer Arbeitsgruppe zeigen, dass dies im HCC (hepatozelluläres Karzinom) und im malignen Melanom auf Promoter-Hypermethylierung zurückzuführen ist. Als Folge dieser verminderten MTAP-Expression akkumuliert MTA sowohl extra- als auch intrazellulär. Weitere Studien ergaben, dass die MTAP-Expression einen Einfluss auf das invasive Potenzial der Tumorzellen hat und damit auch zur Metastasierung des malignen Melanoms beitragen kann. Der Verlust von MTAP könnte Auswirkungen auf therapeutische Ansätze bei Melanompatienten haben. In der Therapie des malignen Melanoms wird seit längerer Zeit in großen Studien Interferon getestet. Es gibt Hinweise, wonach die Expression von MTAP für den Erfolg dieses Therapieansatzes wichtig ist.
Die weiteren Auswirkungen des MTAP-Verlustes und der Akkumulation von MTA sind noch weitgehend unerforscht. Um die Konsequenzen dieses Expressionsverlusts besser verstehen zu können, wird auch die regulatorische Funktion von MTAP näher beleuchtet.
Das Protein MIA, welches im Rahmen der Analyse der molekularen Mechanismen der Melanommetastasierung untersucht wird, konnte in Kooperation mit den dermatologischen Kliniken des Klinikums Regensburg und der TU München als Serummarker des malignen Melanoms etabliert werden. Mehrere Studien, auch von anderen Arbeitsgruppen, konnten den Wert des Markers zeigen und eine Einführung des MIA-ELISAs in die Routinediagnostik bewirken.
Die mögliche Rolle des Proteins MIA in der Diagnostik von chondrozytären Erkrankungen wie rheumatoider Arthritis oder Arthrose wird in verschiedenen Kooperationen im Moment untersucht.


